В настоящее время в оперативной гинекологии все более четко проявляется тенденция к так называемой функциональной хирургии, в том числе у больных с миомой матки. К группе консервативно-пластических операций, сохраняющих как менструальный цикл, так и репродуктивную функцию женщины, относится миомэктомия. Показанием к ней являются:
- Нарушение менструального цикла (маточные кровотечения).
- Большие размеры узла (узлов).
- Субмукозный и центростремительный рост узлов.
- Болевой синдром.
- Анемизация больной.
- Бесплодие и невынашивание беременности.
- Субсерозное расположение узла (на ножке).
- Атипичное расположение узла (шеечное, перешеечное, интралигаментарное).
- Дизурические явления.
Целесообразность проведения миомэктомии оспаривается в связи с отсутствием на сегодняшний день научных доказательств непосредственной связи миомы матки с бесплодием и невынашиванием беременности, а так-же с наличием значительного количества данных о нарушениях генеративной функции после проведенного вмешательства, обусловленных спайкообразованием, спровоцированным операцией (Вихляева Е.М., 2004, Hoffman C.P., Kennedy J., Borschel L. et al., 2005). Кроме того, возможность сохранения детородной функции резко снижается при локализации узлов миомы в области углов матки, при крупных и множественных узлах, деформирующих полость матки, узлах, превышающих в диаметре 10-12 см. В этих случаях, если и удается сохранить матку, значительно возрастает риск осложнений, угрожающих больной при последующих беременностях (Краснопольский В.И., Логутова Л.С., Буянова С.Н., 2005, Wallach E.E., Vlahos N.F., 2004). Отрицательным аргументом в дискуссии является и достаточно высокий уровень рецидивирования миомы по¬сле миомэктомии, колеблющийся в широких пределах: от 2,9 до 51% (Петракова C.А., Буянова С.Н, Мгелиашвили М.В., 2009, Hanafi M., 2005). Большинство исследователей утверждают, что вероятность рецидива связана с тщательностью удаления всех имеющихся миоматозных узлов (Базанов П.А., Волков Н.И., 2002, Fauconnier A. et al, 2000). По данным Е.Л. Бабунашвили (2004) этот риск составляет 8,2%. В то же время сообщается об огромном числе исследований, свидетельствующих о высокой частоте наступления беременности после миомэктомии и низком проценте рецидивов миомы. По данным различных авторов, восстановление генеративной функции после миомэктомии наблюдается в 5-69% случаев (Петракова C.А., Буянова С.Н, Мгелиашвили М.В., 2009, Majak G. et al, 2010). Согласно приводимым в литературе данным после консервативной миомэктомии можно рассчитывать на наступление беременности у каждой 2-3-й женщины (Петракова C.А. с соавт., 2009). Вероятность восстановления естественной фертильности в течение ближайшего года после миомэктомии выше у пациенток с единичным опухолевым узлом (Seracchioli R., Rossi S., Govoni F. et al., 2000). Такое разнообразие взглядов на миомэктомию, по-видимому, можно объяснить нетипичностью операции и неоднородностью оперируемых больных.
Несмотря на продолжающиеся дискуссии, миомэктомия заняла свое место в оперативной гинекологии как операция, являющаяся во многих клинических ситуациях эффективной и целесообразной. Однако и в настоящее время существует много нерешенных и противоречивых вопросов, касающихся техники операции, доступа, выбора места и направления разреза на матке, используемого шовного материала и обеспечения условий для формирования полноценного рубца на матке (Краснопольский В.И., Логутова Л.С., Буянова С.Н., 2005).
Учитывая вышесказанное, становится очевидным, насколько труден и важен правильный выбор объема оперативного вмешательства. Несмотря на значительное число исследований, посвященных функциональной хирургии матки, ряд аспектов требует дальнейшего изучения. Наиболее важными являются снижение травматичности оперативного вмешательства, возможность осуществления прецизионной техники, уменьшение кровопотери, профилактика инфекции и спайкообразования после операции. Одним из путей решения этих проблем является использование новых минимально инвазивных технологий.
Научные публикации свидетельствуют о достаточной эффективности всех имеющихся доступов (лапаротомии, лапароскопии, гистероскопии) при выполнении миомэктомии, выбор которых зависит не только от размеров, количества и расположения узлов, наличия сопутствующей гинекологической и экстрагенитальной патологии, но и от опыта хирурга и наличия необходимого оборудования (Гайдуков С.Н. с соавт, 2011, Majak G. еt al., 2010). Эти критерии менялись в процессе развития лапароскопической оперативной техники, и до настоящего момента не существует каких-либо единых стандартов. Koh C.H. (1996) указывает на возможность эндоскопический миомэктомии при опухоли величиной не более 18 недель беременности. Кулакова В.И., Адамян Л.В. (2000) считают, что общий размер узлов не должен превышать 20-недельную беременность, и расположены они должны быть таким образом, чтобы после энуклеации оставалась возможность полноценного формирования и восстановления стенок матки. Dubuisson J.B. (1992) показанием к чревосечению считает наличие множественной миомы и опухоли больших размеров (более 8 см в диаметре).
Лапароскопический доступ для миомэктомии субсерозных узлов стал методом выбора (Тихомиров А.Л., 2010). Гистерорезектоскопическая миомэктомия признана безопасным и высокоэффективным методом лечения субмукозной миомы матки диаметром до 5 см, который может служить альтернативой гистерэктомии и гормональной терапии, в том числе у пациенток с тяжелой соматической патологией (Исамова У.Ш., Саркисов С.Э., 2008, Стрижаков А.Н., Давыдов А.И., 1997, Munoz J.L. еt al., 2003).
Наиболее дискуссионным является вопрос о выборе доступа при интерстициальной миоме. Эндоскопическое наложение швов на ложе узла - достаточно сложная манипуляция. Даже при хорошем владении лапароскопической техникой добиться должного сопоставления краев раны удается не всегда. Это сложно сделать при большой площади и глубине раны, что бывает при интрамуральном расположении узла. Нередко перед наложением швов для остановки кровотечения применяются различные варианты электрокоагуляции. Деструкция тканей при коагуляции может быть весьма значительной, что препятствует нормальному заживлению миометрия. Полноценность рубца после таких вмешательств, его состоятельность во время беременности и родов сомнительны. По мнению ряда авторов, лапароскопия не позволяет наложить на матку швы, способные обеспечить формирование полноценного рубца (Корсак В.С. с соавт., 2005, Стрижаков А.Н., Давыдов А.И., 2007).
Анализируя случаи разрыва матки после ЛМЭ, Савельева Г.М. с соавт. (2010) считает, что противопоказаниями для этого доступа служат: 2-ой тип субсерозного узла; размеры матки, превышающие 12 недель беременности; наличие множественных интерстициальных узлов; шеечно-перешеечное расположение узла, особенно исходящего из задней стенки (Савельева Г.М., Бреусенко В.Г., Капранов С.А. с соавт., 2010).
Для формирования полноценного рубца большинство хирургов руководствуются следующими принципами: уменьшение краевого повреждение миометрия, тщательное послойное восстановление целостности стенки матки без формирования «полостей» с сохранением
адекватного кровообращения. В этой связи активно обсуждаются вопросы выбора места и направления разреза на матке, шовного материала, эндоскопического способа и рядности наложения швов (Долинский А.К., 2011, Хирш Х.А., Кезер О., Икле Ф.А., 1999). Для предотвращения коагуляционного некроза тканей и сохранения адекватного кровоснабжения в ране предложено использование ультразвукового скальпеля (Попов А.А., Шагинян Г.Г., 2007; Мочайло С.В., Ивах В.И., 2009) и радиоволновой энергии (Сахаутдинова И.В, 2009), которые исключают риск электрического и термического повреждения, уменьшают образование послеоперационных спаек и сроки воспалительных изменений в зоне операции, что доказано при повторных лапароскопиях, послеоперационных УЗИ-исследованиях и в эксперименте.
Для создания оптимальных условий к проведению миомэктомии, уменьшения интраоперационной кровопотери (и необходимости коагуляции), профилактики осложнений рядом ученых были предложены различные приемы: интраоперационное введение сосудосуживающих средств (Мочайло С.В. с соавт., 2009, Цыпурдеева А.А., Долинский А.К., 2011), гормональная подготовка агонистами ГнРГ (Тихомиров А.Л.,2010, Lethaby A. et al., 2002), перевязка внутренних подвздошных артерий (Ищенко А.И., Ланчинский В.И., Бахвалова А.А. с соавт., 2004, Радзинский В.Е. с соавт., 2004), временная окклюзия внутренних подвздошных артерий мягкими сосудистыми зажимами «De Bakey» (Пучков К.В., Андреева Ю.Е., Мельников А.Л., 2009), управляемая вазокомпрессия маточных и яичниковых сосудов атравматичными петлями (Тихомиров А.Л., Кочарян А.А., 2007), эмболизация маточных артерий (Бреусенко В.Г., Краснова И.А., 2011, Тихомиров Л.А. с соавт., 2007). Описанные мероприятия позволяют решить некоторые проблемы стандартной техники ЛМЭ. Дальнейшее усовершенствование и разработка этих направлений позволит рассматривать ЛМЭ как один из перспективных методов хирургического лечения миомы матки.
Критерии выбора лапароскопической миомэктомии, ее методики
Учитывая индивидуальные нюансы течения патологического процесса, а также технические особенности выполнения каждой конкретной миомэктомии, сложно определить четкие стандарты для выбора оптимального оперативного доступа, удовлетворяющего все клинические ситуации.
Лапароскопическую миомэктомию (ЛМЭ) выполняют из трех доступов, используя два 5-мм троакара и один 10-мм - для оптики. Четвертый, 5(10)-мм троакар, применяют при опухолях больших размеров для введения 10-мм жесткого зажима или 5(10)-мм штопора, позволяющих ассистенту совершать тракции за узел с целью натяжения тканей и улучшения визуализации.
Техника операции определяется локализацией, размером, числом, глубиной пенетрации узлов в мышечный слой и преследовала цель: удаление всех обнаруженных узлов с максимальным сохранением окружающего гипертрофированного миометрия. Для формирования полноценного рубца на матке и благоприятного вынашивания последующей беременности наиболее важными аспектами миомэктомии являются:
- выбор разреза на матке;
- вскрытие капсулы и последующее удаление узла в пределах капсулы с сохранением ткани миометрия;
- по возможности удаление нескольких узлов из одного разреза;
- проведение тщательного гемостаза (путем сдавливания сосудов тканями);
- отказ от использования электрокоагуляции;
- использование ареактивного синтетического длительно рассасывающегося шовного материала.
- удаление всех обнаруженных узлов;
- послойное наложение швов без оставления «мертвых» пространств;
- профилактика послеоперационного спайкообразования за счет обеспечения надежного гемостаза и отсутствия ишемии, связанной с чрезмерным сдавливанием тканей, а также исполь¬зования противоспаечных барьеров;
- выполнение миомэктомии без вскрытия полости матки, во избежание образования синехий.
Удаление субсерозных узлов на ножке не вызывает трудностей даже при их значительных размерах (до 15 см) (рис. 1). Ножку узла коагулируют биполярным коагулятором (30-35 Вт) или аппаратом «LigaSure» с последующим пересечением монополярными ножницами (режущий ток 100-130 Вт). Швы на матку не накладывают при наличии небольших размеров десерозированной поверхности и полного гемостаза. В противном случае края раны сближают однорядным серозно-серозным швом.
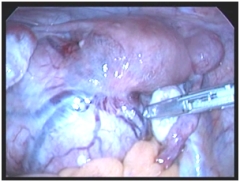
|
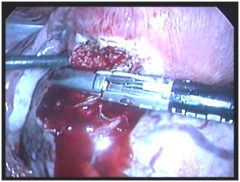
|
| а | б |
| Рис. 1. Удаление субсерозного узла на ножке диаметром 15 см с помощью аппарата «LigaSure»: а – диагностическая лапароскопия, б – поэтапная коагуляция ножки узла. | |
При удалении субсерозных узлов на широком основании используют следующую методику. Узел фиксируют с помощью 10-мм жесткого зажима или 5(10)-мм штопора. Серозный покров матки рассекают по окружности на расстоянии 2 см проксимальнее основания узла монополярным электродом. Это позволяет со¬хранить достаточное количество серозы для последующего закрытия дефекта. Узел вылущивают тупым и острым путем. Рану на матке зашивают серозно-мышечным швом нитью полисорб 1-0 на атравматичной игле с экстракорпоральным завязыванием узлов.
При смешан¬ной субсерозно-интерстициальной или интерстициальной локализации миомы первым этапом эндокрючком линейно рассекают над узлом серозный покров и лежащий ниже слой миометрия, учитывая ход основных сосудов (рис. 2).
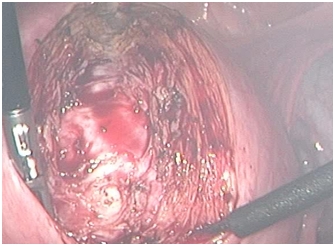
Рис. 2. Рассечение серозы и миометрия эндокрючком над миоматозным узлом.
Наиболее рациональными являются следующие направления разрезов:
- горизонтальные разрезы по выпуклости опухоли;
- косые разрезы (снизу вверх и к середине) – при расположении миомы в области тела матки;
- поперечные разрезы при локализации опухолевых узлов в области перешейка;
- радиальные разрезы по отношению к каналу шейки матки при шеечных фибромиомах.
Если миома смещает или сдавливает маточную трубу, разрез осуществ¬ляют таким образом, чтобы при подтягивании узел передвигался медиальнее от трубного угла, а выделение его происходило в пределах псевдокапсулы. Иногда в подобных случаях прибегают к поперечным разрезам, так как вдали от трубных углов сосуды проходят в радиальном направлении.
Далее узел захватывают 10-мм жестким зажимом (штопором) и отделяют от миометрия тупым путем в пределах псевдокапсулы. При энуклеации миомы очень важно попасть в неваскуляризированный слой, что позволяет достичь значительного снижения кровопотери. Точечную коагуляцию используют только для пересечения участков расщепления серозно-мышечных слоев и псевдокапсулы, что облегчает вылущивание узла (рис. 3). Затем на основание фиброида, содержащего основные сосуды, накладывают 10-мм зажим аппарата «LigaSure».
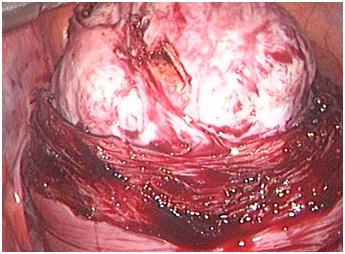
Рис. 3. Энуклеация миоматозного узла с использованием техники «очистки луковицы
Для профилактики вскрытия полости матки мы часто используем технику «очистки луковицы» или «луковичной шкурки» (Koh C.H., 1996), основанную на том факте, что псевдокапсула миомы в действительности представляет собой миометрий, а не фиброзную ткань. Последовательные 1-2 мм разрезы на узле вблизи места расщепления серозно-мышечных слоев и псевдокапсулы облегчает вылущивание узла. Кроме того, данная методика позволяет избежать повреждения сосудов матки при вмешательстве по поводу интралигаментарного узла, а также способствует латеральному смещению маточных сосудов и мочеточника при перешеечной миоме.
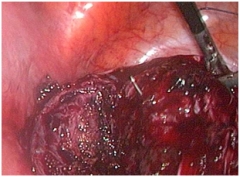
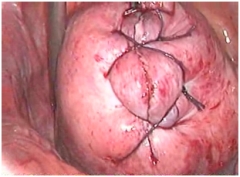
Согласно литературным данным относительно полноценности рубца на матке после ЛМЭ, а также с появлением сообщений о случаях разрыва матки перед родами после данной операции, аккуратное и тщательное ушивание маточного дефекта (даже после поверхностной миомэктомии) крайне необходимо (рис. 4). Не должно оставаться полостей, где бы в послеоперационном периоде могла скапливаться кровь. В связи с этим, важными аспектами этого этапа операции, на наш взгляд, являются:
- Использование рассасывающихся нитей (полисорб-0, викрил-0, PDS-0) с круто изогнутыми иглами.
- При вскрытии полости матки края раны сближаются послойным наложением 3 рядов отдельных узловых или 8-образных швов (слизисто-мышечный, мышечно-мышечный, серозно-мышечный) с экстракорпоральным завязыванием узлов, швы накладывать необходимо таким образом, чтобы сопоставить края слизистой оболочки, но не прокалывать ее во избежание развития эндометриоза в дальнейшем.
- При отсутствии вскрытия полости матки достаточно наложить 2 ряда отдельных швов (мышечно-мышечный, серозно-мышечный).
- Для избежания образования гематом необходимо «прокалывать» всю толщу миометрия с захватом дна раны.
- Необходимо накладывать достаточно редкие швы: первый ряд - через 8-10 мм друг от друга, второй – между узлами первого ряда.
|
|
| а | б |
| Рис. 4. Ушивание дефекта миометрия после энуклеации интерстициально-субсерозного узла диаметром 8 см: а – наложение первого мышечно-мышечного ряда швов, б – заключительный этап операции. | |
Извлечение удаленных миоматозных узлов из брюшной полости является одной из главных проблем лапароскопической миомэктомии, так как часто занимает больше времени, чем сама операция. Из существующих трех способов - минилапаротомии, задней кольпотомии и морцелляции – мы отдаем предпочтение последнему. При использовании электромеханической морцелляции исключается необходимость в больших разрезах и значительно упрощается удаление больших фибром.
Минилапаротомия - расширение умбиликального прокола до 3 см. Макропрепарат сначала погружают в пластиковый контейнер, края которого выводят через расширенный умбиликальный (пупочный) доступ. Затем скальпелем узел фрагментируют. Расширять один из проколов в подвздошной области, считаем не целесообразно, так как усложняется этап фрагментации опухоли из-за более выраженной подкожной клетчатки в этой области.
Таким образом, на наш взгляд, основными критериями отбора пациенток для ЛМЭ являются:
- субсерозная миома матки (независимо и от размеров и числа узлов);
- единичный миоматозный узел межмышечной локализации диаметром не более 8-10 см;
- 3-4 субсерозно-интерстициальных узла не более 5 см диаметром.
Увеличение размера (более 80-100 мм) и количества (более 4) узлов, их интерстициальная и интралигаментарная локализация повышает сложность операции и риск развития осложнений, увеличивает интраоперационную кровопотерю и время операции. В этом случае решение в пользу использования лапароскопического доступа должно основываться на его безопасности для пациентки, адекватности ушивания ложа узла и уровне мастерства хирурга.
Конверсионную лапаротомию при ЛМЭ мы не рас¬цениваем как неудачу, а как мероприятие, направленное на улучшение результатов хирургического лечения и профилактику осложнений беременности и родов.





